编者按:现在我们已经认识到,干细胞治疗机制更多地依赖于旁分泌作用和促血管新生作用。因而,细胞因子的临床作用日益受到科学家的重视,细胞因子治疗承载起了为缺血性心脏病(Ischemia Heart Disease, IHD)的生物治疗带来新革命的厚望。细胞因子对内皮细胞、祖细胞都具有直接和间接的作用,也可能会激活其他血管生成因子的表达,这些作用被认为是细胞因子影响血管新生从而治疗IHD的主要机制。基础研究显示有潜力的细胞因子种类越来越多,干细胞和细胞因子联合治疗也越来越多,临床前研究和小规模观察性临床研究均取得不错的疗效。但令人失望的是,迄今为止,设计更加科学的随机对照临床试验未能重现其良好疗效。那么,究竟该如何看待细胞因子用于IHD治疗的现状和未来走向呢?难道,这一切仅仅是一场遥遥无期的约定?
正方观点:细胞因子治疗必将成为战胜IHD的有效方法
大量动物实验和临床前研究已经证实,细胞因子具有显著改善心肌缺血的作用。
成纤维细胞生长因子(FGF)
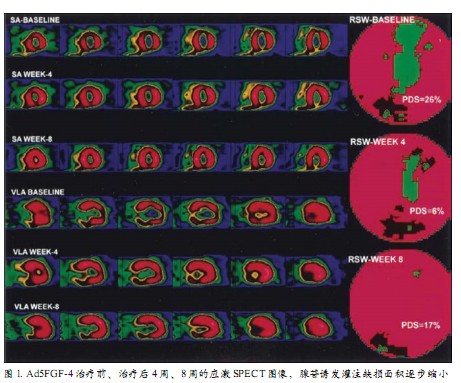
FGF家族由22种多肽组成,通过调节内皮细胞和血管平滑肌细胞表型,促进血管发生和动脉生成。FGF-4由肝素结合分泌转化原癌基因编码,在正常成体组织并不表达。但当注入实验动物缺血心脏时,FGF-4刺激内皮细胞增殖,促进金属蛋白酶、尿激酶型纤维蛋白溶酶原激活剂和血管内皮生长因子的分泌,进而刺激血管生成。AGENT-2临床试验中,冠心病患者冠状动脉内注射Ad5FGF-4后改善心肌灌注(图1)。
血管内皮生长因子(VEGF)
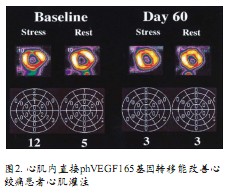
VEGF是最早被发现具有心脏保护作用和再生效应的因子之一。在组织缺氧时,VEGF的治疗获益主要来自刺激内皮细胞增殖、迁移和存活,最后导致新生血管形成。再生作用强度取决于VEGF异构体的组织存留量及其对VEGF受体的亲和力。内皮细胞和造血干细胞(HSCs)均表达VEGF1和2受体 (分别叫做 Flt-1和Flk-1), HSCs上的VEGF受体表达对内皮祖细胞的VEGF依赖性调节甚为关键。动物研究发现,VEGF蛋白可增强慢性心肌缺血动物模型的侧支血流,已有数个I期临床试验评估VEGF血管再生治疗的安全性和可行性(图2)。
VIVA是业已完成的最大的II期临床试验,不适合血运重建的心肌缺血患者被随机分入安慰剂组、低剂量rhVEGF组、高剂量rhVEGF组。2个月随访,VEGF治疗虽安全,但组间较踏车运动时间并无差别;4个月随访,与安慰组相比高剂量VEGF组患者心绞痛改善CCS 1级。在Euroinject One临床试验中,46名CCS 3或4级的心绞痛患者被随机分配到VEGF-A165治疗组和安慰剂组,3个月后随访,灌注缺损组间无差别,但VEGF治疗组局部室壁运动改善。KAT试验比较冠状动脉内注射不同方式转移VEGF基因的治疗效果:CCS 2~3级心绞痛患者在接受PCI时(90%患者接受支架置入) ,被随机分为冠状动脉内注射腺病毒编码VEGF165组、注射VEGF165质粒脂质体组、注射林格氏乳酸盐溶液组;6个月后,三组间心室功能无差别,但腺病毒编码VEGF注射组患者心肌灌注改善。
粒细胞集落刺激因子 (GCSF)
GCSF是一种强有力的造血因子,影响粒细胞的功能和发育,并动员骨髓前体细胞释放入血。GCSF与细胞表面受体结合后,释放酶类消化黏附分子,启动前体细胞动员。GCSF同时直接影响一些非造血细胞如心肌细胞和内皮细胞等的活性。心肌梗死后短期内注射GCSF,可激活Janus激酶/信号转换因子和转录旁路激活因子,刺激产生数种抗凋亡蛋白,减少心肌细胞死亡,限制心肌梗死面积。在鼠心肌梗死动物研究中, GCSF治疗能改善左室功能,增加动脉生成。
粒-巨噬细胞集落刺激因子(GMCSF)
GMCSF刺激粒细胞和巨噬细胞的前体细胞生长和分化,诱导外周血单核细胞增多,减少单核细胞凋亡, 增加循环血EPCs数量。冠心病患者GMCSF首剂冠状动脉内注射,随后皮下注射2周,发现冠状动脉球囊堵塞,心电图心肌缺血征象和侧支血流指数(CFI)均有所改善。推测获益可能来自细胞因子诱导血管新生和侧支血管张力改变有关,而不是前体细胞介导机制,因为前体细胞动员低下。
促红细胞生成素 (EPO)
EPO和血管新生及前体细胞发育有关。许多组织在低氧、代谢应激时,在缺氧诱导因子(HIF)-1的介导下可产生EPO, 激活EPO受体抑制凋亡。EPO通过增加内皮细胞增殖、动员EPCs等骨髓源性细胞等机制促进血管新生。阿法达贝泊汀(Aranesp)是一种长效的EPO类似物,已被安全地使用于急性心肌梗死患者,但并没有显示出益处。HEBE III和REVEA临床试验(NCT00378352,ClinicalTrials.gov)正在进行中,将为急性心肌梗死患者的EPO治疗提供更多证据。
生长激素(GH)和胰岛素样生长因子-1(IGF-1)
GH在垂体前叶合成,GH与心肌细胞上的受体结合可增加IGF-1的合成。已有试验证明GH/IGF在心肌细胞的信号转导中发挥作用。在心肌梗死的动物实验模型中,皮下注射GH能显著提高存活的心肌细胞肥大增生,并提高左室收缩功能,而并不增加胶原沉积和纤维化。不仅如此,心脏干细胞上也有GH受体,参与激活干细胞的心脏修复作用。有几项研究证明,在缺血性和非缺血性心肌病患者中,GH影响心肌生长、心脏功能和IGF水平。总的来说,尽管有视网膜病变和一些潜在的长期副作用,GH或IGF-1仍有必要进行进一步研究。
血管生成素 (Ang)
Ang1, Ang2和Ang3/4 被认为在成体血管发育后期起调控血管重构和稳定血管的作用。Ang1是一种具有Ig样环状结构的酪氨酸激酶,也是一种表皮生长因子同源域-2(TIE2)激动剂,能促进血管存活、抑制血管损害、抑制炎症基因表达、刺激血管重构和新生血管形成。大鼠动物实验中,急性心肌梗死后Ang1注射能增加血管密度,使血管相对成熟,具有较大的血管腔。在猪慢性缺血模型中, Ang1注射后4周心肌灌注改善,并且持续12周之久。令人费解的是,Ang1活性似乎与VEGF诱导的血管新生相反。Ang2是EPCs细胞aTIE2的激动剂,可增加血管新生;但在血管内皮细胞中主要拮抗TIE2,减少内皮完整性、增加血管通透性,诱导血管不稳定性和重构,这种效应至少部分与抑制 Ang1介导作用有关。因此, Ang2对内皮细胞的作用,乃至对血管新生的作用是十分复杂的,可能为环境依赖性。迄今,尚无任何一种Ang尝试用于IHD的临床试验。
肝细胞生长因子 (HGF)
HGF是由肝脏合成的多能性生长因子。动物和人类正常心脏可表达HGF和HGF受体c-Met ,在心肌梗死后HGF水平上调。HGF具有促血管生成和抗细胞凋亡作用,因此被认为具有抑制MI后心脏不良重构的作用。HGF修复心脏的临床试验正在进行中。
胎盘生长因子(PlGF)
PlGF属于VEGF家族,与VEGF受体1结合后, 激活VEGF 受体2, 增强VEGF活性,从而促进血管生成。PlGF调节内皮细胞的生长、存活和迁移;动员骨髓造血干细胞; 趋化单核细胞和巨噬细胞; 诱导单核细胞释放细胞因子促进干细胞向受损心肌归巢。临床前观察研究表明PlGF可改善心肌灌注;但腺病毒PlGF 治疗可导致内膜粥样硬化增厚和外膜新生血管形成。因此在启动临床试验之前,应该施行更多临床前试验证明PlGF的确可以诱导新生血管形成并且不加重动脉粥样硬化。
干细胞因子 (SCF)
SCF是c-kit(CD117)的配体,c-kit是一种表达于成体HSCs的原癌基因受体激酶。c-kitr受体的激活是c-kit阳性HSCs和EPCs动员所必需的,c-kit阳性细胞通过修复再生梗死心肌的直接作用和促进新生血管形成的间接作用,改善心脏重构。SCF和集落刺激因子协同作用,动员骨髓干细胞, 促进 c-kit阳性骨髓衍生细胞的归巢,促进残存心脏干细胞迁移至梗死周围区。回旋支球囊闭塞动物模型研究发现,SCF和GCSF联合治疗可增加心肌灌注血流,但不改善心脏功能。与对照组比较,SCF,GCSF和二者联合治疗均可减少MI鼠类模型的死亡率,但SCF单独治疗并不改善左室功能和重构。SCF和GCSF联合治疗的有效性在小鼠梗死再灌注模型中也得到证实。
 京公网安备 11010502033353号 增值电信业务经营许可证:京ICP证150541号
京公网安备 11010502033353号 增值电信业务经营许可证:京ICP证150541号