流行病学数据显示,我国每年有近百万的新增急性冠脉综合征(ACS)患者,ACS严重危及民众的健康和生命,并带来沉重的经济负担。鉴于血小板的激活和聚集在ACS发生、发展中的重要作用,以阿司匹林和氯吡格雷为代表的双联抗血小板治疗已成为ACS标准治疗方案的一部分。但由于传统抗血小板药物如氯吡格雷仍存在起效较慢、基因多态性影响药物代谢等不足,探寻新型口服抗血小板药物已成为优化ACS患者抗血小板治疗的必由之路。
恢复正常血小板功能需要生成新的血小板,这一过程需要7~10天(血小板寿命)。不可逆性结合导致抗血小板药物停药后抑制效应仍能持续数日,从而提高围手术期出血风险。而替格瑞洛与受体可逆性结合,不但能更快地发挥抑制血小板聚集效应,而且在末次剂量的24小时内,随着血药浓度的下降,抑制作用快速衰减,血小板功能也随之快速恢复。由此可见,替格瑞洛的抑制血小板聚集效应具有可预见性,更为安全可靠。
激活和代谢途径的差异:避免基因多态性的影响
氯吡格雷和普拉格雷均为前体药物,须在肝细胞色素P450酶(CYP)作用下代谢为活性代谢产物方可发挥抑制血小板效应(图2)。此外,这两种噻吩并吡啶类药物之间也存在着差异:氯吡格雷在肝内需经两步代谢,并涉及更多的CYP 酶,尤其是CYP2C19,因此其疗效与安全性常受到CYP2C19基因多态性的影响;而普拉格雷在肝内仅需一步代谢,与氯吡格雷相比起效更为迅速。
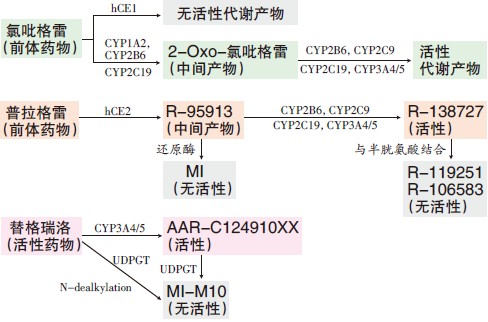
图2 P2Y12 受体抑制剂的代谢途径
注:hCE为人羧酸酯酶;UDPGT为尿苷二磷酸葡萄糖醛酸转移酶;N-dealkylation为N-脱烷基化;
替格瑞洛为非前体药物,无须经肝脏代谢激活,药物本身及其代谢产物均有活性,直接作用于P2Y12受体。因此,它不但可快速强效地抑制ADP介导的血小板聚集,而且其有效性不受肝脏CYP2C19基因多态性影响。这一点在临床上非常重要,因为基因多态性是氯吡格雷反应变异性的主要原因之一,可导致其抗血小板效应难以预测。当患者治疗低反应时,会增加血栓风险;而治疗高反应则会增加出血风险。
额外抗血小板机制探讨
除了通过阻断ADP的激活发挥抗血小板效应外,替格瑞洛还可能具有额外的抗血小板作用机制。在对其机制探讨中,有专家提出这样的观点:替格瑞洛还通过阻断平衡核苷转运蛋白(ENT)、抑制腺苷重摄取、增加血浆中腺苷水平、兴奋A2a受体并激活腺苷酸环化酶,增加血小板内cAMP 水平这种额外机制发挥抗血小板效应。因此,替格瑞洛较之前的P2Y12受体拮抗剂具有更强效的抑制血小板聚集作用。
综上所述,氯吡格雷、替格瑞洛和普拉格雷虽然同属于P2Y12 受体抑制剂,但由于化学结构上的差异、受体结合形式和部位的差异、激活和代谢途径的差异(表),使其在抗血小板的效应上及对临床预后的影响上也不尽相同。对于ACS患者而言,替格瑞洛是可快速起效、强效抑制血小板聚集,并具有确切临床获益的新型口服抗血小板药物,无疑是临床上ACS患者抗血小板治疗的更优选择。



 京公网安备 11010502033353号
京公网安备 11010502033353号