流行病学数据显示,我国每年有近百万的新增急性冠脉综合征(ACS)患者,ACS严重危及民众的健康和生命,并带来沉重的经济负担。鉴于血小板的激活和聚集在ACS发生、发展中的重要作用,以阿司匹林和氯吡格雷为代表的双联抗血小板治疗已成为ACS标准治疗方案的一部分。但由于传统抗血小板药物如氯吡格雷仍存在起效较慢、基因多态性影响药物代谢等不足,探寻新型口服抗血小板药物已成为优化ACS患者抗血小板治疗的必由之路。
 卫生部全国合理用药监测系统孙忠实
卫生部全国合理用药监测系统孙忠实
流行病学数据显示,我国每年有近百万的新增急性冠脉综合征(ACS)患者,ACS严重危及民众的健康和生命,并带来沉重的经济负担。鉴于血小板的激活和聚集在ACS发生、发展中的重要作用,以阿司匹林和氯吡格雷为代表的双联抗血小板治疗已成为ACS标准治疗方案的一部分。但由于传统抗血小板药物如氯吡格雷仍存在起效较慢、基因多态性影响药物代谢等不足,探寻新型口服抗血小板药物已成为优化ACS患者抗血小板治疗的必由之路。
自上世纪60年代双嘧达莫被美国食品与药物管理局(FDA)批准用于抗血小板治疗以来,阿司匹林、噻氯匹定、氯吡格雷相继上市。此后10年,抗血小板药物的研发一直处于停滞期。直至2009年,抗血小板药物研发再度进入活跃期。迄今为止,尽管已研发了多个新型口服抗血小板药物,但仅有替格瑞洛和普拉格雷是获得FDA批准和相关权威指南推荐的新型口服抗血小板药物。
2012年欧洲心脏病学会(ESC)更新的ST段抬高急性心肌梗死治疗指南中明确指出,替格瑞洛或普拉格雷与阿司匹林的双重抗血小板治疗优于氯吡格雷联合阿司匹林。新指南同时建议,当患者不能获得普拉格雷或替格瑞洛治疗时或禁忌使用时才推荐氯吡格雷。由此可见,替格瑞洛或普拉格雷已开始成为抗血小板治疗的新标准之一。
化学结构差异:决定药效学优势
氯吡格雷、替格瑞洛和普拉格雷同属于P2Y12受体抑制剂。P2Y12 受体是与Gi蛋白偶联的血小板膜表面的二磷酸腺苷(ADP)受体之一。当ADP与P2Y12受体结合后,抑制了腺苷酸环化酶的活化,降低了血小板内环磷酸腺苷(cAMP)水平,通过信号途径扩大了血小板的激活反应,促进血小板的分泌和聚集以及血栓素A2(TXA2)的生成。而P2Y12受体抑制剂正是通过阻断ADP 的激活,发挥抗血小板效应。
值得一提的是,尽管P2Y12 受体抑制剂通常被认为是同一类药物,但其化学结构上是有差异的。氯吡格雷和普拉格雷同属噻吩并吡啶类;而替格瑞洛则属于一个新分类——环戊基三唑嘧啶类。同时,由于受体结合形式和部位的不同,以及激活和代谢途径的差异,导致三种药物在药效学和临床疗效上也存在差异。
PRINCIPLE-TIMI 44研究和ONSET/OFFSET研究分别比较了普拉格雷与氯吡格雷、替格瑞洛与氯吡格雷的药效学差异。结果显示,与氯吡格雷相比,普拉格雷和替格瑞洛能更快、更强地抑制血小板聚集。
在ONSET/OFFSET研究中,180 mg 负荷剂量替格瑞洛与600 mg负荷剂量氯吡格雷30分钟内的血小板聚集抑制率(IPA)分别为41%和8%;给予负荷剂量2 h后,替格瑞洛组98%患者达到>50%IPA,而氯吡格雷组仅31%的患者能达到。
TRITON-TIMI 38 研究和PLATO研究则分别比较了普拉格雷与氯吡格雷、替格瑞洛与氯吡格雷对ACS 患者长期预后的影响。结果显示,与氯吡格雷相比,普拉格雷和替格瑞洛更有效降低心血管死亡、心肌梗死和卒中的复合终点事件发生率。
在PLATO 研究中,经过12个月的治疗,与氯吡格雷相比,替格瑞洛可进一步显著降低ACS患者心血管死亡/心肌梗死/卒中组成的复合终点达16%。此外,这两项研究均证明,基因多态性可对氯吡格雷的疗效产生显著影响,但普拉格雷和替格瑞洛则不受基因多态性影响。
在TRITON-TIMI 38研究中,接受氯吡格雷治疗且携带功能缺失等位基因患者的心血管死亡/心梗/卒中发生率高达12.1%,显著高于无携带者组的8%(P=0.01)。
可见,深入了解P2Y12受体抑制剂的不同作用机制,有助于我们在临床实践中更好地选择抗血小板药物。
受体结合形式的差异:可逆性结合,安全性更高
化学结构上的差异导致不同的受体结合形式,从而影响药物的临床表现。氯吡格雷和普拉格雷在化学结构上是噻吩并吡啶类药物,具有相似的化学结构,其活性代谢产物上的活性巯基可与P2Y12受体胞外半胱氨酸残基Cys17 和Cys270 之间形成二硫键(共价键),与P2Y12受体不可逆结合,导致受体结构改变并永久失活。
而替格瑞洛是一种环戊基三唑嘧啶类药物(CPTP),与P2Y12受体可逆性结合,没有构象改变,与受体解离后还能留下完整的受体(图1)。
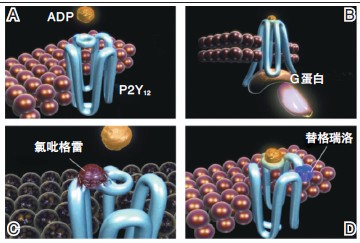
图1 P2Y12 受体抑制剂的受体结合形式和部位



 京公网安备 11010502033353号
京公网安备 11010502033353号