达比加群酯 (Pradaxa®)是一种口服、可逆性、凝血酶直接抑制剂,是应用于预防房颤患者发生卒中的最新口服抗凝药物,具有可预测的稳定的抗凝效果,无需常规监测凝血功能,发生药物相互作用的可能性低,且不会与食物发生相互作用。
要点
治疗目标
通过预防血栓形成降低房颤(AF)患者罹患卒中的风险。
利用抗凝药物预防卒中
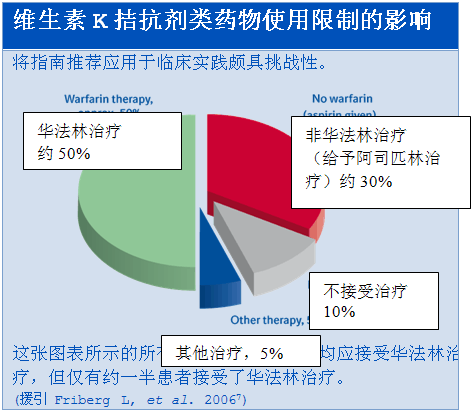
目前,有三分之二的房颤相关性卒中可通过控制良好的维生素K拮抗剂(VKA)治疗而被预防。1
现有维生素K拮抗剂治疗的多种局限性导致目前仅有51%的确诊为房颤且伴有卒中风险的患者接受抗凝治疗。2
注册信息显示,接受抗凝治疗的患者仅有一半时间治疗达标。3
有必要提供一种安全有效且无华法林及其他维生素K拮抗剂治疗限制的新型口服抗凝药物。
展望
达比加群酯 (Pradaxa®)是一种口服、可逆性、凝血酶直接抑制剂,是应用于预防房颤患者发生卒中的最新口服抗凝药物,具有可预测的稳定的抗凝效果,无需常规监测凝血功能,发生药物相互作用的可能性低,且不会与食物发生相互作用。
RE-LY®研究结果显示,最新口服凝血酶直接抑制剂达比加群酯(Pradaxa®)疗效优于华法林。4
抗凝治疗
卒中是房颤的主要并发症,抗凝治疗通过降低动心房上血栓的形成而减少房颤患者的卒中风险。维生素K拮抗剂类药物如华法林是目前推荐用于中度和重度高危患者的抗凝治疗药物,这些患者具有以下一种或一种以上风险因素:5
•年龄 >75岁
•之前曾有卒中/短暂性缺血发作
•高血压
•糖尿病
•心衰
华法林及其他维生素K拮抗剂类药物在患者的凝血指标位于INR2.0-3.0这一狭窄的治疗性区间时非常有效,据一项临床研究显示,可降低卒中风险达67%,可降低死亡风险达26%。1
维生素K拮抗剂类药物如华法林具有诸多应用限制,使得在临床实践中,让患者凝血指标维持在狭窄的治疗区间较为困难、复杂和不方便6,7,例如:
饮料发生相互作用
•与许多药物发生相互作用
•治疗区间狭窄 (INR 2–3)
•需要定期监测INR,并调整剂量以维持INR治疗区间
注册信息显示,接受抗凝治疗的患者仅有一半时间治疗达标。3 INR控制不佳,治疗效果也就会下降:8-10
•抗凝不足 (INR<2)会显著增加卒中风险,INR为1.7时风险加倍,INR为1.5时风险达三倍, INR为1.3时风险增加6倍.11
•抗凝过度 (INR>3.5)可使颅内出血风险骤增。10
达比加群酯和抗凝治疗
•达比加群酯 (Pradaxa®)是可逆性口服凝血酶直接抑制剂。通过特异性和 选择性地阻断凝血酶(游离型或结合型)的活性来发挥抗凝疗效12-14 凝血酶是血栓形成过程中的关键性作用的一种酶。
•Pradaxa®具有可预测的稳定的抗凝效果,无需常规监测凝血功能,发生药物相互作用的可能性小,且不会与食物发生相互作用。14-19
RE-LY® 研究
RE-LY® (长期抗凝治疗的随机评估)研究是一项具有里程碑意义的全球性III期临床研究,也是迄今为止规模最大的(纳入44个国家的共计18,113例患者)有关房颤临床转归的研究,RE-LY®研究结果显示,达比加群酯有望使房颤相关性卒中预防领域发生革命性的改观。4 RE-LY® 比较了达比加群酯和华法林(目标INR 2-3)在预防房颤相关性卒中方面的长期有效性和安全性。20
抗血小板治疗
乙酰水杨酸进行抗血小板治疗在预防房颤相关性卒中方面的效果相对较差且不稳定。1 目前仅被推荐作为口服抗凝治疗的替代药物,用于低度卒中风险人群或对维生素K拮抗剂类药物存在禁忌(包括出血风险增高)的患者。5
抗凝治疗领域有待满足的需求
展望未来
达比加群酯是最新口服抗凝药物,用于预防房颤相关性卒中。RE-LY® 研究显示其作用优于华法林。.4
References
1. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med. 2007;146:857– 67.
2. Hylek EM, D’Antonio J, Evans-Molina C, et al. Translating the results of randomized trials into clinical practice. The challenge of warfarin candidacy among hospitalized elderly patients with atrial fibrillation. Stroke 2006;37:1075–80
3. Samsa GP, Matchar DB, Goldstein LB, et al. Quality of anticoagulation management among patients with atrial fibrillation: results of a review of medical records from 2 communities. Arch Intern Med 2000;160:967–73
4. Connolly SJ. A randomized trial of dabigatran, an oral direct thrombin inhibitor, compared to warfarin in 18,113 patients with atrial fibrillation at high risk of stroke. Oral presentation, ESC Congress 2009, Hot Line I 30 August 2009
5. Fuster V, Ryden LE, Cannom DS, et al. ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association task force on practice guidelines and the European Society of Cardiology committee for practice guidelines. Circulation 2006;114:e257–e354
6. Hirsh J, Dalen JE, Deykin D, et al. Oral anticoagulants. Mechanism of action, clinical effectiveness, and optimal therapeutic range. Chest 1995;108:231S–46S
7. Friberg L, Hammar N, Ringh M, et al. Stroke prophylaxis in atrial fibrillation: who gets it and who does not? Eur Heart J 2006;27:1954–64.
8. Rietbrock S, Plumb JM, Gallagher AM, et al. How effective are dose-adjusted warfarin and aspirin for the prevention of stroke in patients with chronic atrial fibrillation? An analysis of the UK General Practice Research Database. Thromb Haemost 2009;527–34
9. Walker AM, Bennet D. Epidemiology and outcomes in patients with atrial fibrillation in the United States. Heart Rhythm 2008;5:1365–72
10. Hylek EM, Go AS, Yang Y, et al. Effect of Intensity of Oral Anticoagulation on Stroke Severity and Mortality in Atrial Fibrillation. N Engl J Med 2003;349:1019–26
11. Hylek EM, Skates SJ, Sheehan MA, et al. An analysis of the lowest effective intensity of prophylactic anticoagulation for patients with nonrheumatic atrial fibrillation. N Engl J Med 1996;335:540–6
12. Di Nisio M, Middeldorp S, Büller HR, et al. Direct thrombin inhibitors. N Engl J Med 2005;353:1028–40.
13. van Ryn J, et al. 2008 ATVB Oral Presentations (P570). Arterioscler Thromb Vasc Biol 2008; 28:e136–e137
14. Pradaxa, Summary of Product Characteristics, 2008
15. Stangier J. Clinical Pharmacokinetics and Pharmacodynamics of the Oral Direct Thrombin Inhibitor Dabigatran Etexilate. Clin Pharmacokinet 2008;47:285–95
16. Blech S, Ebner T, Ludwig-Schwellinger E, et al. The Metabolism and Disposition of the Oral Direct Thrombin Inhibitor, Dabigatran, in Humans. Drug Metab Dispos 2008;36:386–99
17. Stangier J Stahle H, Rathgen K, et al. No Interaction of the Oral Direct Thrombin Inhibitor Dabigatran Etexilate and Digoxin. J Thromb Haemost 2007;5(Suppl 2),Abstr P-W-672
18. Stangier J Stahle H, Rathgen K, et al. Coadministration of the Oral Direct Thrombin Inhibitor Dabigatran Etexilate and Diclofenac has Little Impact



 京公网安备 11010502033353号
京公网安备 11010502033353号